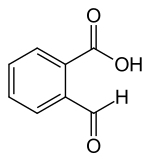
2-Carboxybenzaldehyd
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Carboxybenzaldehyd | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C8H6O3 | ||||||||||||||||||
| Kurzbeschreibung |
weißes bis blassrotes Kristallpulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 150,13 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser, Diethylether, Ethanol[4], in Methanol[1] und Dimethylsulfoxid | ||||||||||||||||||
| Brechungsindex |
1,4500 (25 °C, 589 nm)[5] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
2-Carboxybenzaldehyd ist zugleich ein aromatischer Aldehyd (Benzaldehyd) und eine aromatische Carbonsäure (Benzoesäure) mit orthoständiger Anordnung der Substituenten. Die 2-Formylbenzoesäure steht im Gleichgewicht (Ring-Ketten-Tautomerie) mit dem cyclischen Lactol 3-Hydroxyphthalid, das mit Alkyl- und Aryl-Grignard-Verbindungen substituierte Phthalide bildet.[6] Neben Phthalid-Derivaten leiten sich aus 2-Carboxybenzaldehyd auch andere benzoanellierte Heterocyclen, wie z. B. Isoindolinone oder Phthalazinone[7] mit unterschiedlichen pharmakologischen Eigenschaften ab, darunter u. a. das Antihistaminikum Azelastin.
Vorkommen und Darstellung[Bearbeiten | Quelltext bearbeiten]
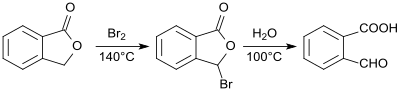
2-Carboxybenzaldehyd wurde erstmals 1887 als Phthalaldehydsäure aus Phthalid dargestellt und beschrieben.[8] Durch Einwirkung von Brom auf Phthalid entsteht 2-Bromphthalid, das durch Erhitzen mit Wasser in einer Gesamtausbeute von 78 bis 83 % in 2-Formylbenzoesäure überführt wird.[9]
Die Synthese von 1-Dichlormethyl-2-(trichlormethyl)benzol durch Photochlorierung von o-Xylol wurde ebenfalls 1887 berichtet.[10]

Die Hydrolyse des Pentachlorxylols zum 2-Carboxybenzaldehyd erfolgt durch Kochen mit FeCl3-haltiger Salzsäure.[11]
Bei der Umsetzung von Phthalsäureanhydrid mit Natriumtetracarbonylferrat wird nur eine der Carboxygruppen zum Aldehyd reduziert, die zweite bleibt unverändert.[12]
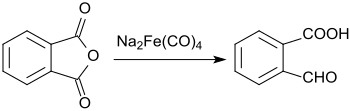
Dabei wird 2-Carboxybenzaldehyd in einer Ausbeute von 61 % erhalten.
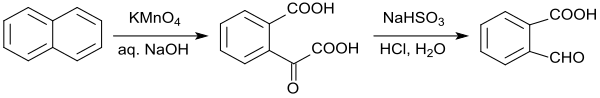
In einer Laborvorschrift ist die Oxidation von Naphthalin mit alkalischem Kaliumpermanganat angegeben, die allerdings nur eine Reinausbeute an 2-Carboxybenzaldehyd von 39 % liefert.[13] Auch die Oxidation von Naphthalin mit Ozon zu 2-Formylbenzoesäure[14] bietet keine wesentlichen Vorteile.
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Reiner 2-Carboxybenzaldehyd ist ein weißes Kristallpulver, das sich in Wasser und in kurzkettigen Alkoholen löst. In fester Form und in den meisten Lösungsmitteln liegt die Substanz in Folge von Ring-Ketten-Tautomerie als (racemisches) 3-Hydroxyphthalid (Lactol) vor.[11]

Anwendungen[Bearbeiten | Quelltext bearbeiten]
In der Lactol-Form als 3-Hydroxyphthalid [3-Hydroxy-1(3H)-isobenzofuranon] verhält sich 2-Carboxybenzaldehyd wie ein Carbonsäureanhydrid und reagiert mit Alkoholen glatt zu 3-Alkoxyphthaliden.[11]

Auch mit anderen nucleophilen Verbindungen, wie z. B. Thiolen, Aminen, Amiden usw., reagiert 3-Hydroxyphthalid ohne Katalysatorzusatz zu den entsprechenden Derivaten.[11] So liefert die Umsetzung mit z. B. Morpholin in 91%iger Ausbeute 3-Morpholinylphthalid.[15]
3-Hydroxyphthalid reagiert mit Thionylchlorid glatt unter Austausch der Hydroxygruppe (80–90 % Ausbeute) zum 3-Chlorphthalid.[15]
Mit Grignard-Verbindungen lässt sich die Hydroxygruppe gegen den entsprechenden Alkyl- bzw. Aryl-Rest austauschen.[6]

In Gegenwart von (+)-Cinchonin können bei der Umsetzung von (racemischem) 3-Hydroxyphthalid mit Carbonsäureanhydriden zu den entsprechenden chiralen 3-substituierten Phthaliden bei hohen Produktausbeuten Enantiomerenüberschüsse bis zu 90 % ee erzielt werden.[16]
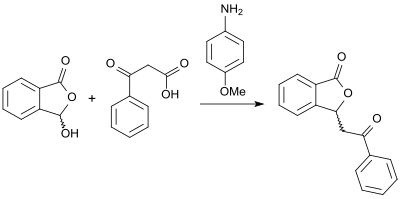
Einen alternativen Zugang zu (racemischen) 3-substituierten Phthaliden mit hohen Ausbeuten eröffnet die Reaktion von 2-Carboxybenzaldehyd und β-Ketosäuren in Gegenwart der Base 4-Anisidin und in Glycerin als Lösungsmittel.[17]
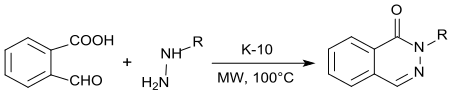
Mit Hydrazin bzw. Alkylhydrazinen entstehen unter Säurekatalyse mit K10-Montmorillonit und Mikrowellenbestrahlung in quantitativer Ausbeute 1-(2H)-Phthalazinone in praktisch quantitativer Ausbeute.[18]
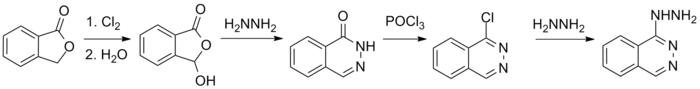
Phthalazinone [1(2H)-Phthalazinone] sind wichtige Bausteine für Naturstoffe, Feinchemikalien und pharmazeutische Wirkstoffe.[19]
Das als Vasodilatator wirksame Antihypertensivum Hydralazin ist aus 1(2H)-Phthalazinon nach Chlorierung zum 1-Chlorphthalazin und Reaktion mit Hydrazin zugänglich.[20]
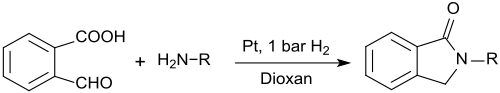
2-Carboxybenzaldehyd eignet sich auch zur Darstellung von N-substituierten Isoindolinonen (1-Isoindolinonen, 2,3-Dihydroindol-1-onen), die bei der Reaktion mit primären Aminen in Gegenwart von Platin-Nanodrähten und geringem Wasserstoffdruck in 1,4-Dioxan in sehr hohen Ausbeuten entstehen.[19]
Führt man die Reaktion von 2-Carboxybenzaldehyd mit primären Aminen in Gegenwart von Dimethylphosphit durch, erhält man zunächst die entsprechenden Isoindolin-1-on-3-phosphonate, die nach Aktivierung mit Butyllithium mit aromatischen Aldehyden, wie z. B. Benzaldehyd in einer Horner-Wadsworth-Emmons-Reaktion in sehr hohen Ausbeuten in 3-(Arylmethylen)isoindolin-1-one überführt werden können.[21]
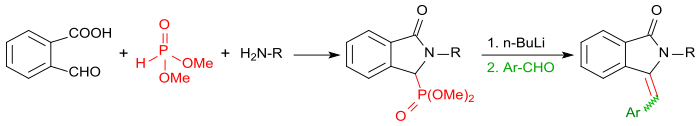
In jüngerer Zeit hat 2-Formylbenzoesäure wegen seiner Reaktivität größeres Interesse als vielseitig verwendbarer Molekülbaustein in Multikomponentenreaktionen, z. B. der Ugi-Reaktion, zum Aufbau heterocyclischer annellierter Aromaten gefunden.
Funktionalisierte Isoindolinone sind in einer Dreikomponenten-Reaktion auch mit 2-Formylbenzoesäure und 2-Bromanilinen durch Palladium-katalysierte Carbonylierung in hohen Ausbeuten zugänglich.[22]

Eine weitere Dreikomponenten-Reaktion – hier als Strecker-Synthese ausgeführt – mit 2-Carboxybenzaldehyd, primären Aminen und Kaliumcyanid in Methanol liefert im sauren Medium ein N-substituiertes Isoindolinon-1-carbonitril, formal mit zwei Mol HCN ein Aminoacetonitril-Derivat des Isoindolinons.[23]

Beim Einsatz von 2-Formylbenzoesäure, Kaliumcyanid und äquimolarer Mengen primärer aromatischer Amine und Essigsäure werden substituierte Isochromen-1-one (Isocumarine, 1H-2-Benzopyran-1-one) in guten Ausbeuten erhalten.[24]

Die erhaltenen Isochromenone lagern sich beim Erhitzen in DMSO unter Ringverengung in substituierte Isobenzofurane bzw. mit katalytischen Mengen Iod in Triethylamin quantitativ in Isoindolinone um.[25]
Mit Isonitrilen statt Kaliumcyanid reagieren 2-Carboxybenzaldehyd und primäre aromatische Amine in Methanol zu substituierten Isochromen-1-onen, die mit Säurespuren zu Isoindolinonen umlagern.[26]

Synthesevarianten für das als Lokalanästhetikum wirksame Isochinolin-Derivat[27] Quinisocain[28] und das Antihistaminikum Azelastin[29] basieren ebenfalls auf 2-Carboxybenzaldehyd als Ausgangsstoff.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d Eintrag zu 2-Carboxybenzaldehyd bei TCI Europe, abgerufen am 30. Juli 2017.
- ↑ a b c d Datenblatt 2-Carboxybenzaldehyde bei Alfa Aesar, abgerufen am 30. Juli 2017 (Seite nicht mehr abrufbar).
- ↑ Datenblatt 2-Carboxybenzaldehyde bei Sigma-Aldrich, abgerufen am 30. Juli 2017 (PDF).
- ↑ William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, Boca Raton, FL, U.S.A. 2016, ISBN 978-1-4987-5429-3, S. 3–278.
- ↑ Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 183.
- ↑ a b P. Cannone, J. Plamondon, M. Akssira: Reactions selectives de organomagnesiens avec les lactols et les lactones. Synthese des diols primaires-secondaires. In: Tetrahedron. Band 44, Nr. 10, 1988, S. 2903–2912, doi:10.1016/S0040-4020(88)90027-0.
- ↑ V. Lad, J.G. Mulla, B.R. Agarwal, M. Farooqui: Nano TiO2: A recyclable catalyst for one pot synthesis of 2-(substituted phenyl)phthalazin-1(2H)-one. In: J. Chem. Pharm. Res. Band 7, Nr. 4, 2015, S. 257–261 (jocpr.com [PDF]).
- ↑ S. Racine: VIII. Ueber Phthalaldehydsäure. In: Justus Liebigs Ann. Chem. Band 239, Nr. 1, 1887, S. 78–91, doi:10.1002/jlac.18872390106.
- ↑ R.L. Shriner, F.J. Wolf: Phthalaldehydic acid In: Organic Syntheses. 23, 1943, S. 74, doi:10.15227/orgsyn.023.0074; Coll. Vol. 3, 1955, S. 737 (PDF).
- ↑ A. Colson, H. Gautier: Nouveau mode de chloruration des carbures. In: Ann. Chim. Phys. Band 6, Nr. 11, 1887, S. 19–32.
- ↑ a b c d D.D. Wheeler, D.C. Young, D.S. Erley: Reactions of phthalaldehydic acid. In: J. Org. Chem. Band 22, Nr. 5, 1957, S. 547–556, doi:10.1021/jo01356a022.
- ↑ Y. Watanabe, M. Yamashita, T-a. Mitsudo, M. Tanaka, Y. Takegami: The facile synthesis of aldehydes and aldehydic acids from carboxylic acid anhydrides using sodium tetracarbonylferrate. In: Tetrahedron Lett. Band 14, Nr. 37, 1973, S. 3535–3536, doi:10.1016/S0040-4039(01)86963-X.
- ↑ J.H. Gardner, C.A. Naylor, Jr.: Phthalaldehydic acid In: Organic Syntheses. 16, 1936, S. 68, doi:10.15227/orgsyn.016.0068; Coll. Vol. 2, 1943, S. 523 (PDF).
- ↑ L. Seekles: Ortho phthalaldehydic acid. In: Rec. Trav. Chim. Band 43, Nr. 5, 1924, S. 329–340, doi:10.1002/recl.19240430506.
- ↑ a b K.B. Sloan, S.A.M. Koch: Effect of Nucleophilicity and Leaving Group Ability on the SN2 Reactions of Amines with (Acyloxy)alkyl a-Halides: A Product Distribution Study. In: J. Org. Chem. Band 48, Nr. 5, 1983, S. 635–640, doi:10.1021/jo00153a002.
- ↑ D. Niedek, S.M.M. Schuler, C. Eschmann, R.C. Wende, A. Seitz, F. Keul, P.R. Schreiner: Synthesis of enantioenriched phthalides and isoindolinone derivatives from 2-formylbenzoic acid. In: Synthesis. Band 49, Nr. 02, 2017, S. 371–382, doi:10.1055/s0036-1589404.
- ↑ L. Jia, F. Han: Sustainable synthesis of 3-substituted phthalides via a catalytic one-pot cascade strategy from 2-formylbenzoic acid with β-keto acids in glycerol. In: Beilstein J. Org. Chem. Band 13, 2017, S. 1425–1429, doi:10.3762/bjoc.13.139.
- ↑ V.M. Outerbridge, S.M. Landge, H. Tamaki, B. Török: Microwave-promoted solid-acid-catalyzed one-pot synthesis of phthalazinones. In: Synthesis. Band 11, 2009, S. 1801–1806, doi:10.1055/s-0028-1088074.
- ↑ a b L. Shi, L. Hu, J. Wang, X. Cao, H. Gu: Highly efficient synthesis of N-substituted isoindolinones and phthalazinones using Pt nanowires as catalysts. In: Org. Lett. Band 14, Nr. 7, 2012, S. 1876–1879, doi:10.1021/ol300471a.
- ↑ J. Druey, B.H. Ringier: 21. Hydrazinderivate der Phthalazin- und Pyridazinreihe. In: Helv. Chim. Acta. Band 34, Nr. 1, 1951, S. 195–210, doi:10.1002/hlca.19510340122.
- ↑ M.A. Reyes-Gonzàlez, A. Zamundio-Medina, M. Ordónez: Practical and highly selective synthesis of 3-(arylmethylene)isoindolin-1-ones from 2-formylbenzoic acid. In: Tetrahedron Lett. Band 53, Nr. 43, 2012, S. 5756–5758, doi:10.1016/j.tetlet.2012.08.040.
- ↑ K. Natte, J. Chen, H. Li, H. Neumann, M. Beller, X.F. Wu: Palladium-catalyzed carbonylation of 2-bromoanilines with 2-formylbenzoic acid and 2-halobenzaldehydes: Efficient synthesis of functionalized isoindolinones. In: Chemistry. Band 20, Nr. 44, 2014, S. 14184–14188, doi:10.1002/chem.201404446.
- ↑ T. Opatz, D. Ferenc: An unexpected three-component condensation leading to amino-(3-oxo-2,3-dihydro-1H-isoindol-1-ylidene)-acetonitriles. In: J. Org. Chem. Band 69, Nr. 24, 2004, S. 8496–8499, doi:10.1021/jo0486802.
- ↑ T. Opatz, D. Ferenc: Facile preparation of 3-amino-4-(arylamino)-1H-isochromen-1-ones by a new multi-component reaction. In: Eur. J. Org. Chem. Band 5, 2005, S. 817–821, doi:10.1002/ejoc.200400685.
- ↑ T. Opatz, D. Ferenc: Ring contracting rearrangements of 3-amino-4-(arylamino)-1H-isochromen-1-ones. In: Eur. J. Org. Chem. Band 1, 2006, S. 121–126, doi:10.1002/ejoc.200500575.
- ↑ C. Faggi, M. Garcia-Valverde, S. Macaccini, G. Menchi: Isolation of Ugi four-component condensation primary adducts: A straightforward route to isocoumarins. In: Org. Lett. Band 12, Nr. 4, 2010, S. 788–791, doi:10.1021/ol9028622.
- ↑ J.W. Wilson, N.D. Dawson, W. Brooks, G.E. Ullyot: Local anesthetics. Aminoalkoxyisoquinoline derivatives. In: J. Am. Chem. Soc. Band 71, Nr. 3, 1949, S. 937–938, doi:10.1002/ja01171a047.
- ↑ F. v. Bruchhausen et al. (Hrsg.): Hagers Handbuch der Pharmazeutischen Praxis, 5. Aufl. Springer, Berlin 1994, ISBN 978-3-642-63389-8, S. 482, doi:10.1007/978-3-642-57880-9.
- ↑ G. Scheffler, J. Engel, B. Kutscher, W.S. Sheldrick, P. Bell: Synthese und Kristallstrukturanalyse von Azelastin. In: Arch. Pharm. Band 321, Nr. 4, 1988, S. 205–208, doi:10.1002/ardp.19883210406.
