Ruthenium(IV)-oxid
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
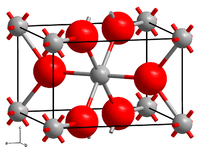
| |||||||||||||||||||
| _ Ru4+ _ O2− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ruthenium(IV)-oxid | ||||||||||||||||||
| Andere Namen |
Rutheniumdioxid | ||||||||||||||||||
| Verhältnisformel | RuO2 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 133,07 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
6,97 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt |
> 955 °C[2] | ||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−305 kJ·mol−1 [3] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Ruthenium(IV)-oxid ist eine chemische Verbindung des Rutheniums aus der Gruppe der Oxide.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Ruthenium(IV)-oxid kann zum Beispiel durch Hydrolyse von Rutheniumhalogeniden (z. B. Ruthenium(III)-chlorid) gewonnen werden.[4]
Einkristalle des Oxides lassen sich durch eine CVT-Methode (Chemical Vapor Transport) herstellen. Hierfür wird zunächst Ruthenium-Schwamm im Sauerstoffstrom bei 1000 °C zum polykristallinen Oxid umgesetzt. Dieses Oxid wird dann in einem 3-Zonen-Ofen im Sauerstoffstrom bei 1190 °C in ein flüchtiges Oxid überführt, welches sich dann in einer kälteren Region des Rohres bei 1090 °C wieder zu Sauerstoff und Ruthenium(IV)-oxid zersetzt, wobei 3 bis 4 mm große Einkristalle der Zielverbindung entstehen. Für die Umsetzung von 2 g des polykristallinen Ausgangsmaterials wird eine Reaktionszeit von etwa 15 Tagen benötigt.[1]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Wasserfreies Ruthenium(IV)-oxid ist blauschwarz und geruchlos. Es besitzt eine Rutil-Kristallstruktur. Daneben existiert auch eine schwarze, hydratisierte Form, welche oberhalb von 75 °C Kristallwasser abspaltet.[5][6]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Ruthenium(IV)-oxid wird für die Beschichtung von Titan-Anoden, wie sie beispielsweise für die Chloralkali-Elektrolyse benötigt werden, und in der Elektronikindustrie verwendet.[7][8] Außerdem wird Rutheniumoxid in Widerstandsthermometern für extrem tiefe Temperaturen verwendet.[9]
Weitere Anwendung findet es im Bereich der Mikroelektronik als Wirksubstanz in Widerstandspasten für die Dickschichttechnik.[10]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b D. B. Rogers et al.: Single crystals of transition-metal dioxides – A. Ruthenium and iridium dioxides. In: F. A. Cotton (Hrsg.): Inorganic Syntheses. Band 13. McGraw-Hill Book Company, 1972, ISBN 0-07-013208-9, S. 135–145 (englisch).
- ↑ a b c d e f g Eintrag zu Ruthenium(IV)-oxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- ↑ A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 2. Band: Nebengruppenelemente, Lanthanoide, Actinoide, Transactinoide. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049590-4, S. 1975 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ H. Schafer: Z.an.allg. Chem. 319, 1963, S. 327.
- ↑ R. W. G. Wyckoff: Crystal Structures. Band 1, Interscience/ John Wiley & Sons, 1963.
- ↑ A. F. Wells: Structural Inorganic Chemistry. 4. Auflage. Clarendon Press, Oxford 1975.
- ↑ O. De Nora: Chem. Eng. Techn. 42, 1970, S. 222.
- ↑ G. S. Iles: Platinum Met. Rev. 11, 1967, S. 126.
- ↑ A low noise thermometer readout for ruthenium oxide resistors. In: Review of scientific instruments. Band 73, Nr. 10, Oktober 2002 (nasa.gov [PDF; 186 kB; abgerufen am 4. August 2011]).
- ↑ Karlheiz Bock: Dickschichttechnik. (PDF) In: Fakultät Elektrotechnik der Technischen Universität Dresden. TU Dresden, 1. Oktober 2014, abgerufen am 18. Februar 2019.


