Thiolate
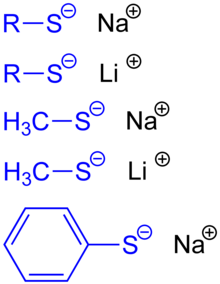
Thiolate (veraltet auch Thioalkoholate oder Mercaptide genannt) sind in der Chemie Salze aus Metallkationen und Thiolatanionen, also Anionen mit Schwefel, der an organische Reste gebunden ist. Die allgemeine Formel lautet (RS)nMe (R = Rest, S = Schwefel, Me = Metallion; n entspricht der Wertigkeit dieses Metallions). Thiolationen entstehen durch Deprotonierung aus Thiolen (Thioalkoholen, Mercaptanen).
Darstellung
[Bearbeiten | Quelltext bearbeiten]Thiolate können durch Reaktion von elementaren Alkalimetallen mit Thioalkoholen (Thiole) synthetisiert werden. Dabei können auch andere Basen, wie beispielsweise Natriumamid eingesetzt werden. Selbst in wässrigem Milieu können Thiolate hergestellt werden, da das Hydroxidion ausreichend basisch ist, um die Thiolgruppe zu deprotonieren und so Alkalihydroxide mit Thioalkoholen umgesetzt werden. Beispielsweise entsteht Natriumthiophenolat durch Einwirkung von Natronlauge auf Thiophenol:
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]In reiner Form sind Thiolate stark basische hygroskopische Feststoffe, ziehen also aus der Luft Feuchtigkeit (Wasser) an und zerfließen allmählich. Sie sind gegen Wasser beständiger als die Alkoholate.[1] Blei(II)- und Quecksilber(II)-thiolate sind schwer löslich und wie andere Schwermetallcaptide kovalente Verbindungen.[2]
Verwendung und Reaktionen
[Bearbeiten | Quelltext bearbeiten]Thiolate finden Anwendung in der Synthese von Thioethern (Sulfiden, R-S-R). Dabei wird (analog zur Williamson-Ethersynthese) in einer nucleophilen Substitution ein Halogenalkan mit einem Thiolat umgesetzt.
Analytischer Nachweis
[Bearbeiten | Quelltext bearbeiten]Durch die Umsetzung von Thiolaten mit 1-Chlor-2,4-dinitrobenzol erhält man die entsprechenden 2,4-Dinitrophenylsulfide mit einem oft charakteristischen Schmelzpunkt:
Siehe auch
[Bearbeiten | Quelltext bearbeiten]- Alkoholate (Sauerstoffanaloga der Thioalkoholate)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag, Leipzig 1965, S. 860.
- ↑ Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, S. 475, ISBN 3-342-00280-8.

