3-Diethylaminophenol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 3-Diethylaminophenol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C10H15NO | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 165,24 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser, Ethanol, Diethylether, Kohlenstoffdisulfid, Petrolether[3] | ||||||||||||||||||
| Brechungsindex |
1,4620 (25 °C, 589 nm)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
3-Diethylaminophenol ist ein Phenol mit einer Diethylaminogruppe in meta-Stellung zur Hydroxygruppe. Die Verbindung dient als Ausgangsstoff für Farbstoffe (besonders Fluoreszenzfarbstoffe) und Pigmente, für Druckfarben, Tätowierfarbe und Haarfärbemittel, sowie für UV-Filter.
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]Die Synthese des 3-Diethylaminophenols, hier als „diethyl meta-amidophenol“ bezeichnet, wurde erstmals 1888 beschrieben.[4]

Dabei wurde 3-Aminophenol unter Druck bei 170 °C mit Ethanol als Ethylierungsmittel umgesetzt und das Reinprodukt durch Extraktion, Destillation und mehrmalige Umkristallisation als weiße kristalline Masse (Smp. 74 °C) erhalten.
Wegen der Bedeutung der N,N-Dialkylaminophenole wurden unterschiedliche Syntheserouten ausgearbeitet – ausgehend von den einfachen Aromaten Nitrobenzol bzw. Anilin oder Phenol – die sich jedoch wegen des Anfalls großer Salzmengen (z. B. bei der Alkalischmelze von 3-Dialkylaminobenzolsulfonsäuren), Korrosivität der Reaktanden und schlechter Ausbeuten nicht durchsetzen konnten.

Ein moderneres Verfahren schlägt als Ausgangsverbindung das preisgünstige Resorcin vor, wobei analog zum beschriebenen 3-Dibutylaminophenol auch 3-Diethylaminophenol erhalten werden soll.[5]

Dabei wird mit dem primären Amin in Gegenwart von Phosphonsäure H3PO3 als Reduktionsmittel zunächst eine der beiden Hydroxygruppen am 1,3-Dihydroxybenzol substituiert und diese anschließend mit dem entsprechenden Alkylhalogenid zum sekundären Amin alkyliert. Die angegebenen Bedingungen (200 °C Temperatur, 12 bar Druck, 6h Reaktionsdauer in der ersten und 6–20h in der zweiten Stufe), große Salzmengen und Ausbeuten unter 70 % lassen diesen Reaktionsweg für ein industrielles Verfahren ungeeignet erscheinen.
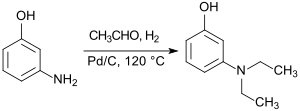
Ausgehend von 3-Aminophenol (z. B. aus Resorcin und Ammoniak[6] bei 230 °C und 35 bar), das mit Acetaldehyd unter 10 bar Wasserstoffdruck in Gegenwart von Palladium auf Aktivkohle einer reduktiven Alkylierung unterworfen wird, kann 3-Diethylaminophenol auch in einem kontinuierlichen Prozess in Ausbeuten bis 95 % erhalten werden.[7]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]3-Diethylaminophenol ist ein weiß-grauer bis rot-brauner kristalliner Feststoff mit stechendem Geruch, der sich in Wasser, Ethanol und Diethylether löst.
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Die Reaktion von 3-Diethylaminophenol mit Acetessigester in Gegenwart von Zinkchlorid/Zinn(II)-chlorid liefert das Cumarin-Derivat 7-Diethylamino-4-methylcumarin,[8]

das als optischer Aufheller für Textilien und als Laserfarbstoff verwendet wird.
Bei der Umsetzung von 3-Diethylaminophenol mit Phthalsäureanhydrid wird 2-(4-(Diethylamino)-2-hydroxybenzoyl)benzoesäure gebildet, deren n-Hexylester DHHB unter der Bezeichnung Uvinul A Plus als UV-A-Filter Sonnenschutzmitteln zugesetzt wird.
Werden in dieser Reaktion doppelt-stöchiometrischen Mengen von 3-Diethylaminophenol eingesetzt, dann erhält man Rhodamin B, einen fluoreszierenden Farbstoff aus der Reihe der Xanthenfarbstoffe.[4] – hier noch „tetraethyl-rhodamine“ genannt.
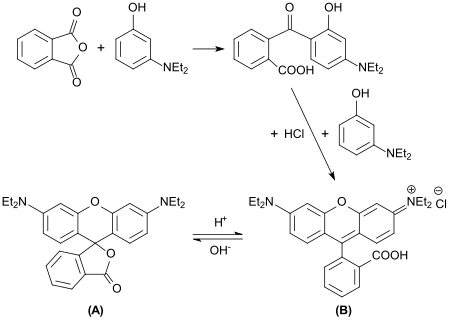
Während die Lacton-Form (A) farblos ist und nicht fluoresziert, zeigen wässrige Lösungen der kationischen ringoffenen Säureform (B) intensive karminrote Farbe und orangerote Fluoreszenz.[4]
Aus 3-Diethlyaminophenol und Malonsäurediphenylester entsteht 7-Diethylamino-4-hydroxycumarin, aus dem durch Umsetzung mit der DHHB-Vorstufe tiefrot fluoreszierende Farbstoffe zugänglich sind, die als Biomarker und Biosensoren Verwendung finden können.

Basische substituierte 1,4-Oxazine bzw. Phenoxazine, wie z. B. der kationische Farbstoff Basic Blue 3, wurden bereits Ende des 19. Jahrhunderts – ausgehend von 3-Diethylaminophenol – als blaue Textilfarbstoffe, insbesondere für Polyacrylnitril-Fasern, synthetisiert.[9]

Dabei reagiert der Ethylether des 3-Diethylaminophenols in Dioxan-Lösung mit Natriumnitrit und Salzsäure zum 6-Nitroso-3-diethylaminophenol, die anschließend mit weiterem 3-Diethylaminophenol in ca. 80 % Ausbeute zum in Substanz grünen Phenoxazinderivat umgesetzt wird.[10] Die Ethoxygruppe wird bei der Kondensationsreaktion zum Phenoxazinringsystem als Ethanol abgespalten.[11]
Bei der Reaktion des Nitrosoderivats des 3-Diethylaminophenols mit 1-Naphthylamin entsteht der Fluoreszenzfarbstoff Nilblau, der durch Erhitzen mit Schwefelsäure in Nilrot übergeht.

Nilrot kann auch aus 3-Diethylaminophenol und 2-Naphthol direkt gebildet werden.
Wegen der Bedeutung der Farbstoffe Nilblau und Nilrot in der Biologie wurden – ausgehend von 3-Diethylaminophenol – eine Vielzahl von Benzophenoxazinen synthetisiert, z. T. auch mit Aktivester-Funktionen zur kovalenten Verknüpfung mit Biomolekülen.[12]
Dichroitische Farbstoffe durch Umsetzung von 3-Diethylaminophenol mit Tetrachlor-p-benzochinon wurden als Mischungskomponenten in so genannten Guest-Host-Displays von Flüssigkristallanzeigen wegen ihres hohen Absorptionskoeffizienten zur Kontrastverbesserung vorgeschlagen.[13]

Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Eintrag zu 3-Diethylaminophenol bei Thermo Fisher Scientific, abgerufen am 13. Januar 2020.
- ↑ a b c d e f Eintrag zu 3-Diethylaminophenol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b c William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, Boca Raton, FL, U.S.A. 2017, ISBN 978-1-4987-5429-3, S. 3–174.
- ↑ a b c Patent US377350: Production of new red coloring-matter. Angemeldet am 17. November 1887, veröffentlicht am 31. Januar 1888, Anmelder: Badische Anilin und Soda Fabrik, Erfinder: M. Ceresole.
- ↑ Patent DE4116830A1: Verfahren zur Herstellung von N,N-disubstituierten m-Aminophenolen. Angemeldet am 23. Mai 1991, veröffentlicht am 26. November 1992, Anmelder: BASF AG, Erfinder: M. Hauptreif, H. Reichelt.
- ↑ Patent EU0197633A1: Method for the production of m-aminophenol. Angemeldet am 12. Februar 1986, veröffentlicht am 15. Oktober 1986, Anmelder: Sumitomo Chemical Co., Ltd., Erfinder: H. Harada, H. Maki, S. Sasaki.
- ↑ Patent US5276193: Process for preparing N-alkyl-substituted aminophenols. Angemeldet am 1. August 1990, veröffentlicht am 1. April 1994, Anmelder: Sumitomo Chemical Co., Ltd., Erfinder: H. Maki, M. Kawasaki, H. Shimizu, Y. Ito.
- ↑ K. Venkataraman (Hrsg.): The Chemistry of Synthetic dyes, Volume V. Elsevier, Inc., Amsterdam 1971, ISBN 0-12-717005-7, S. 599–600.
- ↑ R. Möhlau, K. Uhlmann: Zur Kenntnis der Chinazin- und Oxazinfarbstoffe. In: Liebigs Ann. Chem. Band 289, Nr. 1, 1896, S. 90–130, doi:10.1002/jlac.18962890112.
- ↑ Patent US4196286: Process for the manufacture of basic oxacine dyes. Angemeldet am 21. Dezember 1977, veröffentlicht am 1. April 1980, Anmelder: Ciba-Geigy Corp., Erfinder: E. Brunn.
- ↑ Patent US3655601: Process for the manufacture of basic oxazine dyestuffs. Angemeldet am 13. Februar 1969, veröffentlicht am 11. April 1972, Anmelder: Farbwerke Hoechst AG, Erfinder: N. Ottawa, G. Schäfer.
- ↑ J. Jose, K. Burgess: Benzophenoxazine-based fluorescent dyes for labeling biomolecules. In: Tetrahedron. Band 62, Nr. 48, 2006, S. 11021–11037, doi:10.1016/j.tet.2006.08.056.
- ↑ Patent US6703084B2: Quinone compound, liquid crystal composition, and guest-host-type liquid crystal cell employing the same. Angemeldet am 19. April 2002, veröffentlicht am 9. März 2004, Anmelder: Fuji Photo Film Co., Ltd., Erfinder: T. Katoh.

