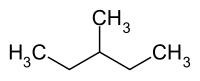
3-Methylpentan
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 3-Methylpentan | |||||||||||||||
| Andere Namen |
1,2,3-Trimethylpropan | |||||||||||||||
| Summenformel | C6H14 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit phenolartigem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 86,18 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte |
0,66 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt |
−118 °C[1] | |||||||||||||||
| Siedepunkt |
63 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (0,018 g·l−1 bei 25 °C)[1] | |||||||||||||||
| Brechungsindex |
1,376 (20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
3-Methylpentan (auch Diethylmethylmethan) ist eines der fünf Konstitutionsisomeren des Hexans.
Darstellung und Gewinnung
[Bearbeiten | Quelltext bearbeiten]3-Methylpentan kommt im Erdöl vor.[3] Eine technische Synthese gelingt durch die Umsetzung von Butan mit Ethylen bei 400 °C und 200 bar in Gegenwart von homogenen Katalysatoren wie Phosphortrichlorid.[4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]3-Methylpentan ist eine leichtentzündliche, leicht flüchtige, farblose Flüssigkeit mit phenolartigem Geruch.[1] Bei Normaldruck siedet die Verbindung bei 63 °C. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 3,97377, B = 1152,368 und C = −46,021 im Temperaturbereich von 289 K bis 337 K.[5]
Die wichtigsten thermodynamischen Eigenschaften sind in der folgenden Tabelle aufgelistet:
| Eigenschaft | Typ | Wert [Einheit] |
|---|---|---|
| Standardbildungsenthalpie | ΔfH0gas | −171,6 kJ·mol−1[6] |
| Standardentropie | S0liquid S0g |
292,5 J·mol−1·K−1[7] als Flüssigkeit 382,88 J·mol−1·K−1[7] als Gas |
| Verbrennungsenthalpie | ΔcH0liquid | −4159,98 kJ·mol−1[7] |
| Wärmekapazität | cp | 191,16 J·mol−1·K−1 (25 °C)[8] als Flüssigkeit |
| Schmelzenthalpie | ΔfH0 | 5,3032 kJ·mol−1[7] beim Schmelzpunkt |
| Schmelzentropie | ΔfS0 | 48,101 kJ·mol−1[7] beim Schmelzpunkt |
| Verdampfungsenthalpie | ΔVH0 | 28,08 kJ·mol−1[9] beim Normaldrucksiedepunkt 30,47 kJ·mol−1[10] bei 25 °C |
| Kritische Temperatur | TC | 231 °C[11] |
| Kritischer Druck | PC | 31,1 bar[11] |
| Kritisches Volumen | VC | 0,368 l·mol−1[11] |
| Kritische Dichte | ρC | 2,72 mol·l−1[11] |
Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der Gleichung ΔVH0=A·exp(−β·Tr)(1−Tr)β (ΔVH0 in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 45,24 kJ/mol, β = 0,2703 und Tc = 504,4 K im Temperaturbereich zwischen 298 K und 353 K beschreiben.[9]
-
Dampfdruckfunktion von 3-Methylpentan
-
Temperaturabhängigkeit der Verdampfungsenthalpie von 3-Methylpentan
Sicherheitstechnische Kenngrößen
[Bearbeiten | Quelltext bearbeiten]3-Methylpentan bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt kleiner −20 °C.[1] Der Explosionsbereich liegt zwischen 1,2 Vol.‑% (40 g/m3) als untere Explosionsgrenze (UEG) und 7,0 Vol.‑% (250 g/m3) als obere Explosionsgrenze (OEG).[12] Es erfolgt eine Zuordnung in die Explosionsgruppe IIB).[12] Die Zündtemperatur beträgt 300 °C.[12] Der Stoff fällt somit in die Temperaturklasse T3.
Verwendung
[Bearbeiten | Quelltext bearbeiten]3-Methylpentan wird als Lösungsmittel für schnelltrocknende Lacke, Druckfarben und Klebstoffe verwendet. Weiterhin findet es Verwendung auch auf dem Brennstoff-, Kraftstoff- und Schmierstoffsektor und als Lösungsmittel und Reaktionsmedien für Kunststoffe und Arzneistoffe.[13] Die Verbindung dient auch als Vergleichssubstanz in der Spektroskopie und Chromatographie.[3]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j k l m n Eintrag zu 3-Methylpentan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ Datenblatt 3-Methylpentane bei Sigma-Aldrich, abgerufen am 18. Mai 2017 (PDF).
- ↑ a b Eintrag zu Methylpentane. In: Römpp Online. Georg Thieme Verlag, abgerufen am 16. Juni 2014.
- ↑ A. A. O’Kelly, A. N. Sachanen: Alkylation of Paraffins in the Presence of Homogeneous Catalysts. synthesis of Neohexane and Triptane, in: Ind. Eng. Chem., 1946, 38, S. 462–467, doi:10.1021/ie50437a010.
- ↑ C. B. Williamham, W. J. Taylor, J. M. Pignocco, F. D. Rossini: Vapor Pressures and Boiling Points of Some Paraffin, Alkylcyclopentane, Alkylcyclohexane, and Alkylbenzene Hydrocarbons, in: J. Res. Natl. Bur. Stand. (U.S.), 1945, 35, S. 219–244.
- ↑ E. J. Prosen, F. D. Rossini: Heats of combustion and formation of the paraffin hydrocarbons at 25 °C, in: J. Res. Natl. Bur. Stand. (U.S.), 1945, 35, S. 263–267.
- ↑ a b c d e H. L. Finke, J. F. Messerly: 3-Methylpentane and 3-methylheptane: low-temperature thermodynamic properties, in: J. Chem. Thermodyn., 1973, 5, S. 247–257, doi:10.1016/S0021-9614(73)80085-0.
- ↑ K. Ohnishi, I. Fujihara, S. Murakami: Thermodynamic properties of decalins mixed with hexane isomers at 298.15K. 1. Excess enthalpies and excess isobaric heat capacities, in: Fluid Phase Equilib., 1989, 46, S. 59–72, doi:10.1016/0378-3812(89)80275-4.
- ↑ a b V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation, Blackwell Scientific Publications, Oxford, 1985, S. 300.
- ↑ I. Wadso: A heat of vaporization calorimeter for work at 25 °C and for small amounts of substances, in: Acta Chem. Scand., 1966, 20, S. 536–543, doi:10.3891/acta.chem.scand.20-0536.
- ↑ a b c d T. E. Daubert: Vapor-Liquid Critical Properties of Elements and Compounds. 5. Branched Alkanes and Cycloalkanes, in: J. Chem. Eng. Data, 1996, 41, S. 365–372, doi:10.1021/je9501548.
- ↑ a b c E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen – Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- ↑ Eula Bingham, Barbara Cohrssen: Patty’s Toxicology, 6 Volume Set. John Wiley & Sons, 2012, ISBN 978-0-470-41081-3 (books.google.com).





