4-Brombenzonitril
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 4-Brombenzonitril | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H4BrN | ||||||||||||||||||
| Kurzbeschreibung |
farbloses Kristallpulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 182,03 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
wenig löslich in Wasser (0,2 g·l−1 bei 24 °C, gut löslich in Aceton (388 g·l−1 (24 °C)[1], Ethanol, Diethylether, Chloroform[4] | ||||||||||||||||||
| Brechungsindex |
1,5999 (25 °C, 589 nm)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
4-Brombenzonitril (abgekürzt 4-BBN) ist ein Halogenaromat mit einer Cyanogruppe in para-Stellung zum Bromatom. Die Verbindung stellt einen vielseitigen Molekülbaustein (engl. building block) für chemische Zwischenprodukte dar, z. B. von substituierten Benzophenonen als Vorstufe für NSAIDs, von symmetrischen und unsymmetrischen Biphenylen und funktionellen 1,3,5-Triazinen durch Trimerisierung für Flüssigkristalle und UV-Filter, sowie für DPP-Hochleistungspigmente oder OLED-Materialien.
Vorkommen und Darstellung[Bearbeiten | Quelltext bearbeiten]
Die meisten Synthesevarianten für 4-Brombenzonitril gehen aus von 4-Brombenzaldehyd (aus 4-Bromtoluol[5] durch Bromierung nach der SSS-Regel und anschließende Hydrolyse des entstehenden 4-Brombenzalbromids[6]), der mit Hydroxylamin bzw. Hydroxylaminhydrochlorid HACl zum entsprechenden Oxim reagiert. Für die Dehydratisierung des Oxims werden mehrere Routen angegeben, die in hohen Ausbeuten 4-Brombenzonitril liefern, z. B. mit dem wasserentziehenden Dicyclohexylcarbodiimid DCC in Gegenwart von Kupfer(II)ionen und Triethylamin (NEt3).[7]
Eine breit anwendbare Alternativroute ohne das problematische Reagenz DCC bietet das Erhitzen des 4-Brombenzaldehyds mit HACl in Dimethylsulfoxid DMSO (Ausbeute 99 %),[8] wobei der Chlorwasserstoff aus dem HACl aktivierend auf DMSO als Dehydratisierungagens auf das intermediär gebildete Oxim wirkt.
Bei Raumtemperatur verläuft diese Reaktion mit Sulfurylfluorid SO2F2 in Gegenwart der Base NEt3 in Chloroform[9]

oder in DMSO in Gegenwart von Natriumcarbonat Na2CO3[10] in Ausbeuten > 90 %.
Dehydratisierung von 4-Brombenzamid mit einem Zirkonium-Komplex erzeugt 4-BBN in einer Ausbeute von 93 %.[11]
Ammonoxidation von 4-Bromtoluol mit einem Gemisch aus Ammoniak und Sauerstoff an einem Vanadium(V)-oxid/Phosphorpentoxid-VPO-Kontakt bei ca. 400 °C liefert analog zum beschriebenen o-Bromtoluol 4-Brombenzonitril.[12]

Eigenschaften[Bearbeiten | Quelltext bearbeiten]
4-Brombenzonitril ist ein farbloser kristalliner Feststoff mit Bittermandelgeruch, der nach Sublimation im Vakuum in langen, hochflexiblen Nadeln kristallisiert, die sich mechanisch biegen und verdrillen lassen.[13] 4-BBN löst sich sehr wenig in Wasser, aber gut in Alkoholen wie Methanol und Ethanol und in organischen Lösungsmitteln, wie z. B. Aceton, Chloroform und Diethylether.
Anwendungen[Bearbeiten | Quelltext bearbeiten]
In einer Palladium-katalysierten Buchwald-Hartwig-Kupplung kann 4-Brombenzonitril unter Mikrowellenbestrahlung in brauchbaren Ausbeuten mit Imidazol in N-(4-cyanophenyl)imidazol überführt werden.[14]
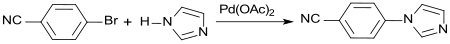
4-Brombenzonitril kann mithilfe von Bis(cycloocta-1,5-dien)nickel Ni(COD)2 zu dem symmetrischen Biphenyl 4,4‘-Dicyanobiphenyl verknüpft werden.[15]

Der Aufbau unsymmetrischer Cyanobiphenyle gelingt durch Kumada-Kupplung mit 4-Brombenzonitril.[16]

Unter geeigneten Reaktionsbedingungen können bei hohen chemischen Ausbeuten (> 90 %) unsymmetrische Cyanobiphenyle im Verhältnis 20:1 zu den als Nebenprodukten anfallenden Benzophenonen erhalten werden.
Im Schlüsselschritt einer neuen Synthese des besonders nach Operationen des Grauen Stars eingesetzten NSAID Bromfenac[S 1] reagiert 2-Indolinon mit 4-BBN in einer Friedel-Crafts-Acylierung zum Ketimin, das anschließend zum entsprechenden Benzophenon hydrolysiert wird.[17]
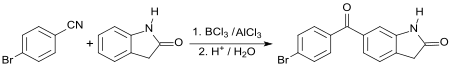
Ein intensiv rotes Diketopyrrolopyrrol-Pigment wird bei der Umsetzung von 4-Brombenzonitril mit Bernsteinsäure-di-tert-amylester (durch Umesterung von Bernsteinsäuredimethylester[18]) in Gegenwart von Natrium-tert-amylat in tert-Pentanol (2-Methylbutan-2-ol) als Lösungsmittel erhalten.[19]
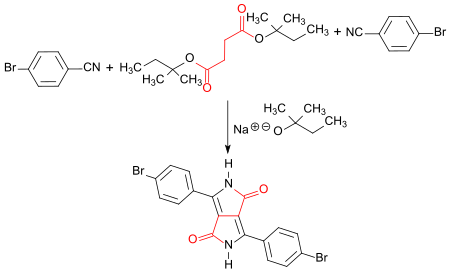
Dem Reaktionsansatz werden geringe Mengen eines Rotpigments, z. B. eines Chinacridon-Pigments zur Verhinderung des Partikelwachstums der Zielverbindung zugesetzt. Das erhaltene DPP-Pigment ist sehr temperaturstabil mit einer Zersetzungstemperatur oberhalb 500 °C und eignet sich als Toner und als rotes Farbfilter für Bildschirme und Farbdisplays.
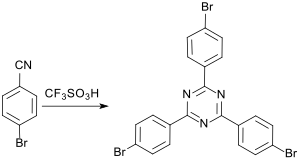
4-Brombenzonitril cyclotrimerisiert in Gegenwart von Trifluormethansulfonsäure TfOH zu dem farblosen Feststoff 2,4,6-Tris(4-bromphenyl)-1,3,5-triazin (Ausbeute 85 %).[20]
Das Trimerisierungsprodukt von 4-BBN kann als Ausgangsmaterial für den Aufbau dreiarmiger Sternmoleküle durch Sonogashira-Kupplung mit endständigen Alkinen dienen.[21]
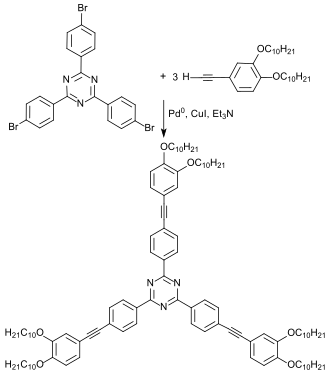
Die erhaltenen Verbindungen sind flüssigkristallin. Sie bilden teilweise kolumnare Phasen und zeigen intensive grün-blaue Photolumineszenz.[22]
Suzuki-Reaktion von 4-Brombenzonitril mit 2,4-Difluorbenzolboronsäure erzeugt 2,4-Difluoro-4‘-cyanobiphenyl (74 %), das mit TfOH in hoher Ausbeute (89 %) zum 1,3,5-Triazin cyclotrimerisiert werden kann.[23]

Mit Caesiumcarbonat CsCO3 dotierte Filme aus derart funktionalisierten Triazinen könnten sich als effiziente Elektronenakzeptoren in n-dotierten Elektronentransportschichten von blau phosphoreszierenden OLEDs eignen.
4-BBN bildet mit Natriumazid/Ammoniumchlorid NaN3/NH4Cl in einer 1,3-dipolaren Cycloaddition 4-Bromphenyltetrazol (98 % Ausbeute), das mit 4-Brombenzoylchlorid zum symmetrischen 2,5-Diaryl-1,3,4-oxadiazol umgesetzt wird (91 %).

Verknüpfung dieses gebogenen Molekülgrundgerüsts an den para-ständigen Bromatomen mit mesogenen Gruppen erzeugt gebogene (bananenförmige) (engl. bent-shaped oder banana-shaped) Moleküle mit starker blauer Fluoreszenz, die ebenfalls für OLED-Anwendungen in Betracht kommen.[24]
Kommerzielles Interesse findet 4-Brombenzonitril und das daraus abgeleitete Trimerisierungsprodukt 2,4,6-Tris(4-bromphenyl)-1,3,5-triazin in dem in einer Suzuki-Reaktion mit Benzolboronsäure zugänglichen Breitspektrum-UV-Filter 2,4,6-Tris(biphenyl-4-yl)-1,3,5-triazin, der unter dem Markennamen Tinosorb® A2B in kosmetischen Sonnenschutzmitteln eingesetzt wird.[25]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e NITRALZ® 4-Brombenzonitril. AlzChem Group AG, 9. Juni 2020, abgerufen am 5. Mai 2021.
- ↑ a b Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 136.
- ↑ a b c Datenblatt 4-Brombenzonitril bei Sigma-Aldrich, abgerufen am 18. Mai 2022 (PDF).
- ↑ a b William M. Haynes: CRC Handbook of Chemistry and Physics, 94th Edition. CRC Press, Boca Raton, FL, U.S.A. 2016, ISBN 978-1-4665-7115-0, S. 3–60.
- ↑ L.A. Bigelow: p-Bromotoluene In: Organic Syntheses. 5, 1925, S. 21, doi:10.15227/orgsyn.005.0021; Coll. Vol. 1, 1941, S. 136 (PDF).
- ↑ G.H. Coleman, G.E. Honeywell: p-Bromobenzaldehyde In: Organic Syntheses. 17, 1937, S. 20, doi:10.15227/orgsyn.017.0020; Coll. Vol. 2, 1943, S. 89 (PDF).
- ↑ E. Vowinkel, J. Bartel: Ein Eintopfverfahren zur Überführung von Aldehyden in Nitrile. In: Chem. Ber. Band 107, Nr. 4, 1974, S. 1221–1227, doi:10.1002/cber.19741070418.
- ↑ J.K. Augustine, A. Bombrun, R.N. Atta: A practical and cost-efficient, one-pot conversion of aldehydes into nitriles mediated by ‚activated DMSO‘. In: Synlett. Band 15, 2011, S. 2223–2227, doi:10.1055/s-0030-1261181.
- ↑ J. Gurjar, J. Bater, V.V. Fokin: Sulfuryl fluoride mediated conversion of aldehydes to nitriles. In: Chem. Eur. J. Band 25, 2018, S. 1906–1909, doi:10.1002/chem.201805175.
- ↑ W.-Y. Fang, H.-L. Qin: Cascade process for direct transformation of aldehydes (RCHO) to nitriles (RCN) using inorganic reagents NH2OH/Na2CO3/SO2F2 in DMSO. In: J. Org. Chem. Band 84, Nr. 9, 2019, S. 5803–5812, doi:10.1021/acs.joc.8b03164.
- ↑ R.T. Ruck, R.G. Bergman: Zirconium-Mediated Conversion of Amides to Nitriles: A Surprising Additive Effect. In: Angew. Chem. Int. Ed. Band 43, Nr. 40, 2004, S. 5375–5377, doi:10.1002/anie.200461064.
- ↑ Patent US4124631: Process for the production of aromatic nitriles. Angemeldet am 10. März 1977, veröffentlicht am 7. November 1978, Anmelder: Nippon Kayaku K.K., Erfinder: H. Hayami, H. Shimizu.
- ↑ L.A. Alimi, P. Lama, V.J. Smith, L.J. Barbour: Hand-twistable plastically deformable crystals of a rigid small organic molecule. In: Chem. Commun. Band 54, Nr. 24, 2018, S. 2994–2997, doi:10.1039/C8CC00775F.
- ↑ Y. Wan, M. Alterman, A. Hallberg: Palladium-catalyzed amination of arylbromides using temperature-controlled microwave heating. In: Synthesis. Band 11, 2002, S. 1597–1600, doi:10.1055/s-33342.
- ↑ M.F. Semmelhack, P.M. Helquist, L.D. Jones: Synthesis with zerovalent nickel. Coupling of aryl halides with bis(1,5-cyclooctadiene)nickel(0). In: J. Amer. Chem. Soc. Band 93, Nr. 22, 1971, S. 5908–5910, doi:10.1021/ja00751a062.
- ↑ Patent US6121480: Method for producing unsymmetrically substituted biphenyls. Angemeldet am 24. Februar 1997, veröffentlicht am 19. September 2000, Anmelder: Great Lakes Chemical Konstanz GmbH, Erfinder: B. Kohler, M. Langer, T. Mosandl.
- ↑ Patent CN106397235A: Bromfenac sodium preparation method. Angemeldet am 31. August 2016, veröffentlicht am 23. Februar 2018, Anmelder: Chenxin Fodu Pharmaceutical (Wenshang) Co. Ltd., Erfinder: L. Zhang, S. Sun, Z. He, C. Si, B. Zhang.
- ↑ Patent EP0278914A2: Verfahren zur Herstellung von tert.-Alkylestern der Bernsteinsäure. Angemeldet am 8. Februar 1988, veröffentlicht am 17. August 1988, Anmelder: Ciba-Geigy AG, Erfinder: U. Frei, R. Kirchmayr.
- ↑ Patent US8273269B2: Red colour filter composition. Angemeldet am 5. Mai 2009, veröffentlicht am 25. September 2012, Anmelder: BASF SE, Erfinder: R. Lenz, G. de Keyzer, M. Duggeli, P.C. Holzhuter.
- ↑ Matthias Bohle et al.: Science of Synthesis: Houben-Weyl Methods of Molecular Transformations Vol. 17 Six-Membered Hetarenes with Two Unlike or More than Two Heteroatoms and Fully Unsaturated Larger-Ring Heterocycles. Georg Thieme Verlag, Stuttgart 2004, ISBN 3-13-118671-2, S. 50.
- ↑ Sandeep Kumar: Chemistry of Discotic Liquid Crystals: From Monomers to Polymers. CRC Press, Boca Raton, FL, USA 2011, ISBN 978-1-4398-1145-0, S. 213.
- ↑ C.-H. Lee, T. Yamamoto: Synthesis and characterization of a new class of liquid-crystalline, highly luminescent molecules containing a 2,4,6-triphenyl-1,3,5-triazine unit. In: Tetrahedron Lett. Band 42, Nr. 24, 2001, S. 3993–3996, doi:10.1016/S0040-4039(01)00640-2.
- ↑ J.S. Swensen, J.E. Rainbolt, L. Wang, P.K. Koech, E. Polikarpov, A.B. Padmaperuma, D.J. Gaspar: Blue phosphorescent organic light-emitting devices utilizing cesium–carbonate-doped 2,4,6-tris(2′,4′-difluoro-[1,1′-biphenyl]-4-yl)-1,3,5-triazine. In: J. Photonics Energy. Band 1, Nr. 1, 2011, S. 011008, doi:10.1117/1.3528003.
- ↑ R. Cristiano, F. Ely, H. Gallardo: Light-emitting bent-shape liquid crystals. In: Liqu. Cryst. Band 32, Nr. 1, 2005, S. 15–25, doi:10.1080/02678290412331329279.
- ↑ S. Kotha, D. Kashinath, M. Lopus, D. Panda: Synthesis of nano-sized C3-symmetric 2,4,6-triphenyl-1,3,5-s-triazine and 1,3,5-triphenylbenzene derivatives via the trimerization followed by Suzuki-Miyaura cross-coupling or O-alkylation reactions and their biological evaluation. In: Indian J. Chem. 48B, Nr. 12, 2009, S. 1766–1770.
Anmerkungen[Bearbeiten | Quelltext bearbeiten]
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Bromfenac: CAS-Nummer: 91714-94-2, PubChem: 60726, ChemSpider: 54730, DrugBank: DB00963, Wikidata: Q2487682.
