N,N-Dimethylaminododecan
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | N,N-Dimethylaminododecan | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C14H31N | ||||||||||||||||||
| Kurzbeschreibung |
klare, farblose Flüssigkeit[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 213,40 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck |
0,012 hPa bei 20 °C[2] | ||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[3], löslich in Chloroform und Isopropanol, mischbar mit organischen Lösungsmitteln[5] | ||||||||||||||||||
| Brechungsindex |
1,4354 (25 °C, 589 nm)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Dodecyldimethylamin (DDA) ist ein tertiäres Fettamin mit einer linearen C12-(Dodecyl)-Kohlenstoffkette und zwei Methylgruppen am Stickstoffatom. Die an Laurinsäure (Dodecansäure) besonders reichen Pflanzenöle Kokosöl und Palmöl sind nachwachsende Rohstoffe für die oleochemische Synthese von Lauryldimethylamin, das wiederum wichtiger Ausgangsstoff für grenzflächenaktive Tenside und antibakteriell wirksame Quats sind.
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]Dodecyldimethylamin ist keine natürlich vorkommende Verbindung, aber aus funktionalen n-Dodecanderivaten auf unterschiedlichen Wegen im Labor- und Industriemaßstab zugänglich. Synthesen aus Dodecylbromid und Dimethylamin oder Dodecylamin und Dimethylsulfat eignen sich eher für Kleinmengen, während die Eschweiler-Clarke-Methylierung von Dodecylamin mit Ameisensäure-Formaldehyd-Gemisch[6] N,N-Dimethylaminododecan mit ca. 90 % Ausbeute liefert.
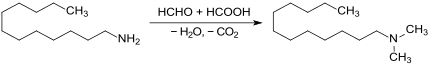
Das primäre Amin Laurylamin kann auch mit Formalin und Wasserstoff an einem Nickel-Kontakt zu N,N-Dimethyldodecylamin umgesetzt werden (93,6 % Ausbeute).[7]
Dodecanol reagiert mit Dimethylamin und Wasserstoff an einem Kupferchromit-Kontakt in 95 %iger Ausbeute zu DDA.[8]
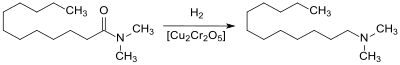
Für die industrielle Produktion sind Syntheserouten relevant, die direkt von den fraktionierten Verseifungsprodukten der Pflanzenöle, d. h. von Laurinsäure oder Laurinsäuremethylester ausgehen. Direkte Amidierung von Laurinsäure mit Dimethylamin liefert zunächst das Salz Dimethylammoniumlaurat, das durch Wasserabspaltung beim Erhitzen in N,N-Dimethyldodecanamid übergeht.[9]

Statt Laurinsäure kann auch der Methylester eingesetzt werden, wie er bei der Biodieselherstellung durch Umesterung der Pflanzenöle mit Methanol und destillativer Abtrennung als reines Methyllaurat (oder eines laurinsäurereichen C12/C14-Gemischs) anfällt.[10] Das Carbonsäureamid lässt sich aus dem Ester in Ausbeuten > 90 % mit Dimethylamin und Natriummethanolat als Katalysator bei wesentlich niedrigeren Temperaturen (ca. 100 °C) als aus der Carbonsäure gewinnen. Ein weiterer Vorteil der Prozessführung bei möglichst niedrigen Temperaturen ist die Verminderung bzw. Vermeidung von Gelbfärbung und insbesondere Geruchsbildung.
Das N,N-Dimethyldodecanamid kann an Nickel-[11] oder industriell an Kupferchromit-Kontakten[12] praktisch quantitativ zu DDA hydriert werden.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]N,N-Dimethylaminododecan ist eine farblose Flüssigkeit mit ammoniakalisch-fischartigem Geruch, der überwiegend von Verunreinigungen mit Triethylamin herrührt, das durch Erhitzen im Vakuum oder Durchleiten von Stickstoff praktisch vollständig entfernt werden kann.[13]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Das Amin Dodecyldimethylamin und seine Salze mit Mineralsäuren, wie z. B. Phosphorsäure oder Schwefelsäure finden Einsatz als Korrosionsschutzmittel, Asphaltemulgatoren, Flotationshilfsmittel, Additive für Kühlschmiermittel und Bohrspülungen.[14] Das freie Amin ist Ausgangsstoff für grenzflächenaktive Verbindungen mit unterschiedlichen funktionellen (kationischen, nichtionischen und amphoteren) Kopfgruppen, wie z. B.
Quats aus DDA
[Bearbeiten | Quelltext bearbeiten]Quaternisierung von Dodecyldimethylamin zu einem auch als Quat bezeichneten Dodecyltrimethylammoniumsalz kann mit Alkylierungsmitteln wie z. B. Methylchlorid, Methylbromid, Dimethylsulfat oder Dimethylcarbonat durchgeführt werden.

Die Umsetzung mit überschüssigem gasförmigem Methylchlorid erfolgt in einem Autoklaven bei erhöhter Temperatur, wobei das quartäre Ammoniumchlorid in quantitativer Ausbeute als farbloses Pulver gebildet wird.[15] Die Reaktion in den anderen, flüssigen Alkylierungsmitteln liefert die entsprechenden C12-Ammoniumsalze, die gut wasserlöslich, aber meist hygroskopisch sind. Dodecyltrimethylammoniumchlorid (CAS # 112-00-5) wird als Schaumstabilisator, Phasentransferkatalysator, Antistatikum und besonders als Bakteriostatikum genutzt.
Aminoxide aus DDA
[Bearbeiten | Quelltext bearbeiten]Mit 35 %igem Wasserstoffperoxid wird N,N-Dimethylaminododecan zum Aminoxid Dodecyldimethylaminoxid oxidiert,[16] das grenzflächenaktive Eigenschaften besitzt und wegen seiner synergistischen Effekte mit anionischen und nichtionischen Tensiden in Shampoos und Reinigungsmitteln verwendet wird.

Betaine aus DDA
[Bearbeiten | Quelltext bearbeiten]Carboxymethylierung von Dodecyldimethylamin mit Monochloressigsäure MCA bzw. Natriummonochloracetat SMCA in Ethanol/Wasser-Gemisch 1:1 liefert das amphotere Tensid Dodecyldimethylbetain (Laurylbetain) (CAS # 683-10-3), das wegen seiner geringen Haut- und Augenreizung in Babyshampoos, als Schaumstabilisator und -verstärker, als Dispergiermittel, z. B. für Pflanzenschutzmittel, sowie als Verdickungs- und Benetzungsmittel eingesetzt wird.

Laurylbetain – als Derivat der Aminosäure Glycin bzw. Betain, bei dem eine Methylgruppe durch eine C12-Alkylgruppe (blau) ersetzt ist – ist nicht zu verwechseln mit Lauramidopropylbetain, bei dem die C12-Acylgruppe (rot) aus der Laurinsäure stammt. Das Amidopropylbetain wird durch Reaktion von Laurinsäure mit 3-Aminopropyldimethylamin zum Amidoamin und anschließende Carboxymethylierung mit MCA erhalten.

Sulfobetaine aus DDA
[Bearbeiten | Quelltext bearbeiten]Sultone, wie z. B. Propansulton, reagieren mit Lauryldimethylamin zum entsprechenden Sulfobetain Laurylsulfobetain (CAS # 14933-08-5), das Membranproteine weitgehend ohne Denaturierung solubilisiert.
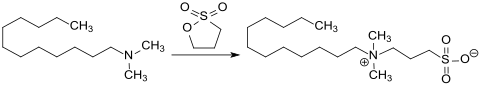
Während die Carboxylatgruppe des Aminosäurederivats Laurylbetain im Sauren (pH<5) zur Carboxygruppe protoniert und das Betain zu einem kationischen Tensid wird, bleibt das entsprechende Sulfobetain auch bei stark saurem pH-Wert vollständig dissoziiert, behält also seinen zwitterionischen Charakter.
Hydroxysultaine aus DDA
[Bearbeiten | Quelltext bearbeiten]Eine zusätzliche Hydroxygruppe und damit eine noch hydrophilere Kopfgruppe als Sulfobetaine weisen Hydroxysultaine auf, wie sie z. B. bei der Reaktion des Natriumsalzes von 1-Chlor-2-hydroxypropansulfonsäure CHPS (durch Anlagerung von Natriumhydrogensulfit NaHSO3 an Epichlorhydrin) mit N,N-Dimethyldodecylamin zu Laurylhydroxysultain (CAS # 13197-76-7) gebildet werden.

Hydroxysultaine sind in Wasser neutrale und sehr milde amphotere Tenside, die auch in hartem Wasser oder Salzwasser stark schäumen und über einen weiten pH-Bereich stabil sind. Sie sind mit allen Tensidklassen gut verträglich und gut bioabbaubar. Als so genannte Co-Surfactants ermöglichen Hydroxysultaine den geringeren Einsatz von Standardtensiden und vermeiden wegen ihrer viskositätserhöhenden Wirkung den Zusatz von Natriumchlorid.[17]
Hersteller und Lieferanten
[Bearbeiten | Quelltext bearbeiten]N,N-Dimethylaminododecan wird von Albemarle Corporation (adma® 12), Eastman Chemical (Dimla™ 12), Global Amines (einem Gemeinschaftsunternehmen der Clariant AG und Wilmar International) (Genamin® 12 R302 D), Kao Corporation (FARMIN® DM2098), Solvay S.A. (Fentamine® Dma12) und einigen asiatischen Unternehmen hergestellt und vermarktet.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu DIMETHYL LAURAMINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 25. Juni 2020.
- ↑ a b c d e f Eintrag zu Dodecyldimethylamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Februar 2023. (JavaScript erforderlich)
- ↑ a b c d e Datenblatt N,N-Dimethyldodecylamin bei Sigma-Aldrich, abgerufen am 14. Juni 2020 (PDF).
- ↑ a b Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 475.
- ↑ Technical Data Sheet: DIMLA TM 1214. Eastman Chemical Co., 21. August 2019, abgerufen am 18. Juni 2020.
- ↑ Patent US2366534: Production of long-chain tertiary amines. Angemeldet am 30. Juli 1941, veröffentlicht am 2. Januar 1945, Anmelder: E.I. du Pont de Nemours & Co., Erfinder: J.E. Kirby.
- ↑ Patent EP0323573A2: Verfahren zur Herstellung von tertiären N,N-Dimethylaminen. Angemeldet am 30. November 1988, veröffentlicht am 12. Juli 1989, Anmelder: Hoechst AG, Erfinder: J. Weber, D. Kampmann, C. Kniep.
- ↑ Patent US7402702B2: Process for producing tertiary amines. Angemeldet am 30. November 2005, veröffentlicht am 22. Juli 2008, Anmelder: Kao Corp., Erfinder: S. Oguri, T. Nishimura.
- ↑ R.M. Lanigan, T.D. Sheppard: Recent developments in amide synthesis: Direct amidation of carboxylic acids and transamidation reactions. In: Eur. J. Org. Chem. Band 33, 2013, S. 7453–7465, doi:10.1002/ejoc.201300573.
- ↑ Patent US3288794: Method of making amides of dimethylamine and piperazine. Angemeldet am 9. September 1963, veröffentlicht am 29. November 1966, Anmelder: The C.P. Hall Company of Illinois, Erfinder: V.P. Kuceski.
- ↑ J. Ding, L. Chen, R. Shao, J. Wu, Z. Yu, W. Dong: Synthesis of N,N-dimethyldodecylamine by the catalytic hydrogenation of N,N-dimethyldodecylamide. In: REACT KINET MECH CAT. Band 108, Nr. 1, 2013, S. 151–159, doi:10.1007/s11144-012-0505-6.
- ↑ Patent EP1736463B1: Process for obtaining amines by reduction of amides. Angemeldet am 22. Juni 2005, veröffentlicht am 5. Oktober 2011, Anmelder: Taminco N.V., Erfinder: R. Loenders, I. van den Eynde, P. Vanneste.
- ↑ Patent EP0723952B2: Verfahren zur Reinigung von tertiären Fettalkylmethylaminen. Angemeldet am 20. Januar 1996, veröffentlicht am 20. September 2000, Anmelder: Clariant GmbH, Erfinder: B. Papenfuhs, H. Seitz, A. Gallus.
- ↑ Patent US3308161: Alkali metal-dimethyl dodecyl amine salts of oxyacids of phosphorous and sulfur. Angemeldet am 21. Mai 1962, veröffentlicht am 7. März 1967, Anmelder: Petrolite Corp., Erfinder: K.-T. Shen.
- ↑ Patent DE3713996A1: Verfahren zur Herstellung von quartären Ammoniumhalogeniden. Angemeldet am 27. April 1987, veröffentlicht am 10. November 1988, Anmelder: Henkel KGaA, Erfinder: H. Rutzen, P. Lorenz, H. Tesmann.
- ↑ Patent DE19528945A1: Verfahren zur Herstellung von tertiären Aminoxiden. Angemeldet am 7. August 1995, veröffentlicht am 13. Februar 1997, Anmelder: Hoechst AG, Erfinder: G. Baeder, R.J. Tamarg.
- ↑ BETADET® S-20. In: Technical Data Sheet. Kao Corporation, S.A., abgerufen am 20. Juni 2020.


