Phenylcyanat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Phenylcyanat | ||||||||||||||||||
| Andere Namen |
Cyansäurephenylester | ||||||||||||||||||
| Summenformel | C7H5NO | ||||||||||||||||||
| Kurzbeschreibung |
farblose, stechend riechende Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 119,12 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Phenylcyanat ist eine chemische Verbindung aus der Gruppe der organischen Cyanate und ein Bindungsisomer zum Phenylisocyanat.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Das flüssige Phenylcyanat ist relativ stabil. Seine Neigung zur Trimerisierung zu Cyanursäuretriphenylestern (siehe Cyanursäure) wird durch Brønsted-Säuren und -Basen, Lewis-Säuren (vgl. hierzu Säure-Base-Konzepte) sowie Phenol begünstigt.[3]
Darstellung
[Bearbeiten | Quelltext bearbeiten]Die Darstellung von Phenylcyanat durch nukleophile Substitution, also der Reaktion zwischen Alkaliphenolat und Halogencyan (z. B. Bromcyan), gelingt nur unter besonderen Bedingungen. Wird Halogencyan mit einem Überschuss Alkoholat umgesetzt, werden zunächst Iminokohlensäureester erhalten.
Diese bilden weiterhin Trimerisierungsprodukte in Form von Cyanursäuretriphenylestern.[1]
Wird jedoch in das Reaktionsgemisch bestehend aus Phenol und Halogencyan Base eingetropft, liegt das Phenolat-Ion stets in geringer Konzentration vor. Es wird bevorzugt Phenylcyanat erhalten, die Iminokohlensäureester-Bildung wird unterdrückt.[4]
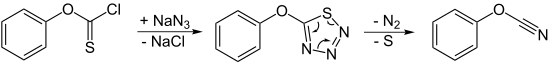
Eine andere Möglichkeit, die Trimerisierung zu verhindern ist die thermische Umsetzung von Vorläuferverbindungen, die die O-C-N-Gruppierung vorgebildet halten. Lässt man Thiokohlensäure-O-phenylester-chlorid mit Natriumazid zu 5-Phenoxy-1,2,3,4-thiatriazol reagieren, kann dieses thermolytisch in guter Ausbeute zum gewünschten Produkt umgesetzt werden.[1]
Geschichte
[Bearbeiten | Quelltext bearbeiten]John Ulric Nef wies die Bildung der aus Reaktion zwischen Alkaliphenolat und Halogencyan entstehenden Iminokohlensäureester und Cyanursäureestern nach. Dieses Ergebnis konnte unabhängig von Nef reproduziert werden, sodass die von anderen Autoren vermeintlich erhaltenen Cyansäureester als widerlegt galten. Erst 1960 gelang die Cyansäureester-Synthese aus sterisch gehinderten Phenolen.[4] 1964 zeigten Ernst Grigat und Rolf Pütter, wie Cyansäureester erhalten werden können, wenn Phenolat als Reaktionskomponente in niedriger Konzentration eingesetzt wird. Im gleichen Jahr gelang D. Martin die Synthese von Phenylcyanat mittels thermolytischer Umsetzung.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d D. Martin: Cyansäurephenylester. In: Angewandte Chemie. Nr. 76, 1964, S. 303.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ E. Grigat, R. Pütter: Chemie der Cyansäureester, I. Cyansäureester aus Hydroxylverbindungen und Halogencyan. In: Chemische Berichte. Nr. 97, 1964, S. 3013.
- ↑ a b E. Grigat, R. Pütter: Chemie der Cyansäureester, I. Cyansäureester aus Hydroxylverbindungen und Halogencyan. In: Chemische Berichte. Nr. 97, 1964, S. 3012.